Chimie Quantique II (F)
Résumé de section
-
Université : Djilali Bounaama Khemis Miliana
Faculté : Science de la Matiére et Informatique
Département : Science de la matière
Spécialité : Chimie.
Niveau : Troisième Année Licence.
Module : Chimie Quantique II.
Semestre: 1
Crédit : 05.
Unité : Fondamentale.
Coefficient : 3.
Horaire de cours : 1h30 min, 3 séance dans la semaine (1 cours et 1 TD)
Salle de cours : Dimanche(cours, salle 30) / (TD salle 30)
Enseignant chargé de cours: Dr.Fizir Meriem.
spécialité: Analyse Pharmaceutique.
Diplome : Docteur en analyse pharmaceutique.
Grade: MCA
Contacte : Vous pouvez me contacter sur meriem.fizir@univ-dbkm.dz à partir de 6h le soir.
Modalité d'évaluation:
L'évaluation finale est réalisée à travers:
- Évaluation des travaux dirigées : qui représente 33% (12 points sur les interrogations, 5 points sur la présence et 3 points sur la participation).
- Un examen final sur table : qui compte pour 67% de la note finale , et qui porte sur tout ce que vous avez vu dans ce cours pendant le semestre.
- Pour réussira le module il faut que la moyenne générale est supérieure ou égale à 10 sur 20
-
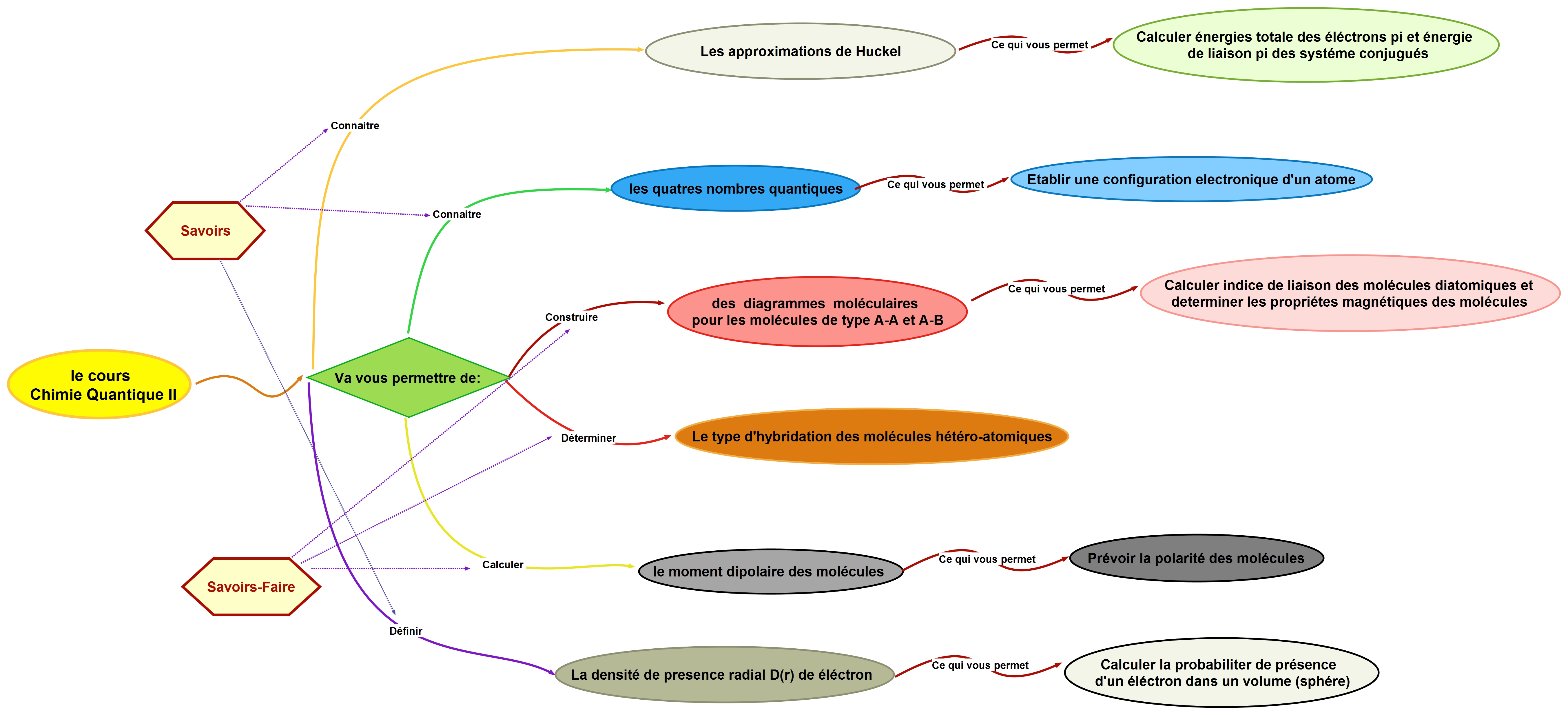
- A l'issu de ce cours, l'étudiant pourra :
Connaître le comportement électronique des molécules
Calculer les énergies des orbitales atomiques de différents atomes
Analyser les spectres d’émission des différents espèces chimiques
Interpréter les propriétés des espèces chimiques par utilisation des notions de la mécanique
quantique
Identifier le types d'hybridation de différents types des molécules
Différencier entre les molécules polaires et apolaires
Calculer la probabilité de présence d'un électron dans un volume (sphère)
Déterminer les énergies des orbitales moléculaires des électrons π dans les systèmes
d'hydrocarbures conjugués.
- A l'issu de ce cours, l'étudiant pourra :
-
- Pour avancer en toute fluidité à travers les notions présentées dans se cours, et tirer le maximum de ce dernier, il faut connaître :
La composition nucléaire des atomes
Les types des liaison chimiques dans les molécules (liaison sigma et pi)
Maths ( Trigonométrie, Résoudre les équations de différent degrés, Intégrales et Dérivées des
fonction mathématiques).
- Pour avancer en toute fluidité à travers les notions présentées dans se cours, et tirer le maximum de ce dernier, il faut connaître :
-
La chimie quantique est une branche de la chimie théorique qui applique la aux mécanique quantique systèmes moléculaires pour étudier les processus et les propriétés chimiques.
Le comportement électronique et nucléaire des molécules étant responsable des propriétés chimiques ne
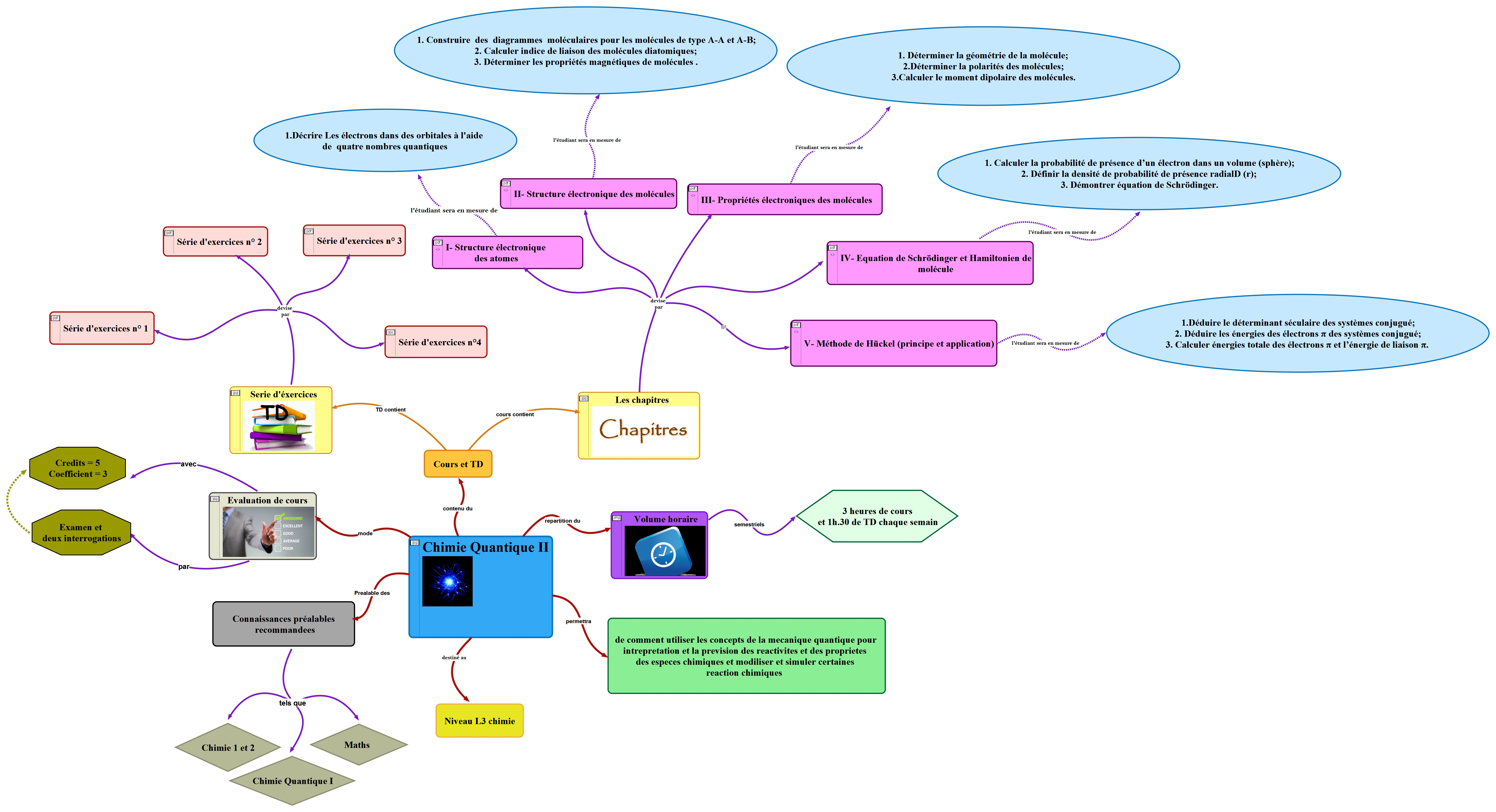
peut être décrit adéquatement qu'à partir de l'équation du mouvement quantique (Équation de Schrödinger) et des autres postulats fondamentaux de la mécanique quantique. Cette nécessité a motivé le développement de concepts (notamment orbital moléculaire, ...) et de méthodes de calculs numériques qui ont permis à la chimie moderne de faire des progrès considérables tant en ce qui concerne la compréhension des phénomènes que des applications. Cette cours contient 5 chapitres :
Chapitre I : Structure électronique des atomes;
Chapitre II : Structure électronique des molécules;
Chapitre III : Propriétés électroniques des molécules
Chapitre IV : Équation de Schrödinger et Hamiltonien de molécule
Chapitre V: Méthode de Hückel (principe et application).
Ces chapitres sont présentés de manière progressive de sorte que l'étudiant puissent d’adapté à la nouvelle manière d'apprentissage. Le cour théorique est renforcée par des exercices d'évaluation en cour et des séries d'exercices qui sont résolues aux séances de TD. Les étudiants sont aussi orientés vers des liens d'apprentissage à savoir des cours en ligne ou des vidéos explicatifs plus détaillés -
Objectifs intermédiaires du chapitre et pré-requis nécessaires
Au terme du cours, les étudiants seront capables de :
Connaître les quatre nombres quantiques
Connaître la géométrie des orbitales atomiques
Établir une configuration électronique d'un atome
Calculer énergie d'absorption et d'émission des atomes excités
Analyser les spectres d'émission des atomesL'acquisition de pré-requis pour ce cours regroupe les concepts suivants:
la composition nucléaire d'un noyaux
Classification des raies du spectre du lumière -
Au terme du ce chapitre, les étudiants seront capables de :
Construire des diagrammes moléculaires pour les molécules de type A-A et A-B
Calculer indice de liaison des molécules diatomiques
Déterminer les propriétés magnétiques de molécules diatomiques homo et hétéro nucléaire
Déterminer le type d'hybridation des molécules hétéro-atomiques
Les deux pré- requis nécessaires à la compréhension de cette deuxième chapitre sont:
la configuration électroniques des atomes ( voir chapitre I)
la géométrie des orbitales atomiques ( voir chapitre I) -
Bibliographie
- Introduction à la chimie quantique : Claude Leforestier. Edition Dunod; 2005.
- Élément de Chimie quantique à l'usage des chimistes ( 2éme édition) : Jean-Louis Rivail. Edition : EDP Sciences; 1999
- B.VIDAL, Chimie Quantique, ED. Masson, 1992.
- D. Mac QUARRIE, I,D,SIMON, Chimie physique : approche moléculaire, Ed, Dunod, 2000.
- P. HIBERTY,N?T.ANH,Introduction à la chimie quantique, Ed. Ecole Polytechnique, 2008.
- C. LEFORESTIER, Introduction à la chimie quantique, Cours et exercices corriges, Ed. Dunod, 2005.
- Structure électronique des molécules. Géométrie, réactivité et méthode de Hückel - Structure électronique des molécules cours et exercices corrigés. De Yves Jean, François Volatron Dunod.1994.
- Hückel théorie pour les Chimistes organiques, C. A. Coulson, B. O'Leary et R. B. Mallion, Academic Press, 1978.
- Utilisation de la théorie des orbitales moléculaires Huckel dans l'interprétation des spectres visible de Teintures polyméthine: Une expérience de premier cycle chimie physique, D. Bahnick, A. J. Chem. Educ. 1994, 71, 171.
- Hückel théorie et la spectroscopie photoélectronique, E. vonNagy-Felsobuki, I. J. Chem. Educ. 1989, 66, 821.

