II.2.3. - Gaz carboniques (CO2)
Section outline
-
D’une part le CO2 provient de la diffusion par l’atmosphère, d’une autre part, il provient de l’activité biologique des organismes aquatiques (respiration et décomposition de la matière organique).
Le gaz carbonique rentre en réaction avec l’eau pour former l’acide carbonique.

Il joue aussi un rôle dans les fluctuations du pH de l’eau (processus chimique), et rente dans le processus de la photosynthèse (processus biochimique).
Ces deux processus engendrent des variations quotidiennes du pH et de la concentration du gaz carbonique de l’eau.
- Une partie du CO2 reste bloquée sous forme de sel de carbonate CO3- - et d’hydrocarbonate (HCO3-).
- Les sels de carbonate se diluent difficilement dans l’eau.
- Les sels d’hydrocarbonates se diluent facilement quand la concentration du gaz carbonique dans l’eau devient nulle.
Quand les plantes absorbent tout le gaz carbonique de l’eau, les sels d’hydrocarbonate vont réagir avec l’eau et vont produire l’acide carbonique et le gaz carbonique.
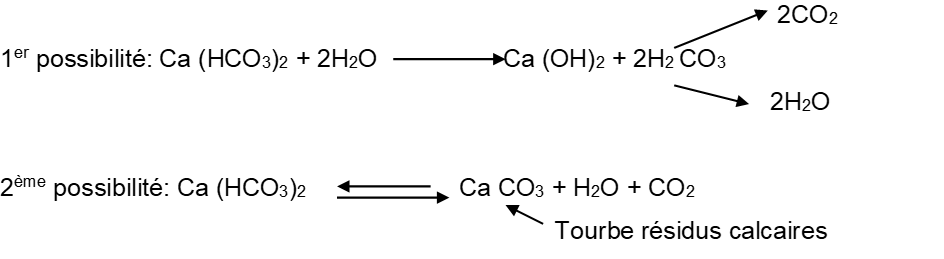
La présence de gaz carbonique, d’ion d’hydrocarbonate (HCO3-) et d’ion carbonate (CO3- -), dans l’eau varie en fonction du pH (voir tableau ci-dessous.
Tableau : Concentration de CO2 de HCO3- et CO3- - en fonction du pH de l’eau
pH de l’eau
Concentration en % de la quantité totale de :
CO2
HCO3-
CO3- -
5
97,09
2,91
0,00
6
74,92
23,08
0,00
7
25,00
75,00
0,00
8
3,21
96,31
0,48
9
0,32
94,94
4,74
10
0,02
66,66
33,32
La concentration optimale de gaz carbonique dans l’eau est de 1,5 à 5 mg/l. Les limites de concentration maximales sont de 20 mg/l.
Les valeurs supérieures à 20 mg/l deviennent dangereuses pour les animaux aquatiques.
La toxicité des gaz carboniques dans de cas pareils agit sous l’influence de la température, du pH, de la dureté de l’eau, et de l’oxygène dissous.
Dans une eau dure, pauvre en oxygène, pH acide, et ayant une température basse, la concentration de gaz carbonique augmente, d'où une toxicité importante.


